 Los ácidos y bases se describen como sustancias que se encuentran en la naturaleza, pueden distinguirse tomando en cuenta su nivel de pH, es decir, su alcalinidad o grado de acidez. Sin embargo, los dos son sustancias corrosivas, en ocasiones tóxicas, que al mismo tiempo tienen muchas aplicaciones humanas e industriales.
Los ácidos y bases se describen como sustancias que se encuentran en la naturaleza, pueden distinguirse tomando en cuenta su nivel de pH, es decir, su alcalinidad o grado de acidez. Sin embargo, los dos son sustancias corrosivas, en ocasiones tóxicas, que al mismo tiempo tienen muchas aplicaciones humanas e industriales.
Los ácidos son sustancias que tienen un pH por debajo de 7, tomando en cuenta que el pH del agua es igual a 7 y es neutro.
Su química se compone normalmente de cantidades grandes de iones de hidrógeno cuando se le agrega agua. Normalmente reacciona a otras sustancias al perder protones. Por otro lado, las bases son sustancias que tienen un pH por encima de 7, en las disoluciones acuosas aportan iones de hidroxilo al ambiente.
Suelen ser muy oxidantes, lo que significa que absorben protones en el ambiente circundante. La reacción entre bases y ácidos se llama neutralización y elimina las propiedades de los dos compuestos creando sal y agua en su lugar.
Características de los Ácidos y las Bases
Sabor
 Los ácidos y las bases pueden distinguirse de forma fácil gracias a su sabor. Las bases poseen un gusto amargo que le caracteriza, por el contrario, los ácidos son agrios como el ácido del limón. Hay algunas bases que tienen menos intensidad y sus sabores se asemejan al jabón.
Los ácidos y las bases pueden distinguirse de forma fácil gracias a su sabor. Las bases poseen un gusto amargo que le caracteriza, por el contrario, los ácidos son agrios como el ácido del limón. Hay algunas bases que tienen menos intensidad y sus sabores se asemejan al jabón.
Nomenclatura y Nombre
El origen del nombre de los ácidos proviene del idioma latín y significa agrio. En cambio, las bases tienen su nombre por el idioma árabe y se traduce como ceniza. L nomenclatura de ambos en la química actual se guía de que los ácidos se llaman de esta forma tomando en cuenta los componentes que están juntos al hidrógeno. En el caso de las bases, se les llaman hidróxidos porque se refieren a la molécula OH que corresponde al óxido de hidrógeno, el cual se presenta en estos compuestos.
Conductividad eléctrica
Las bases y los ácidos tienen buena conducción de la electricidad en disoluciones acuosas. Esto gracias a que pueden producir iones con carga eléctrica.
Neutralización
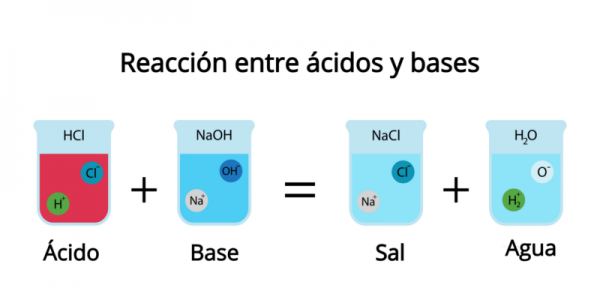
Al unir un ácido con una base, se crea un efecto de neutralización en el cual los protones se liberan gracias al ácido y se absorben por la base. Ambos pierden todas o una parte de sus propiedades químicas. Como consecuencia de esta reacción, se crea alguna clase de sal y agua tomando en cuenta la base y el ácido que están inmersos en el proceso. Por esta razón, la sustancia que resulta no es alcalina ni agria, sino salada.
Reactividad
Las bases y los ácidos se diferencian en que estos últimos otorgan protones mientras que las bases los absorben de las sustancias que les hacen compañía. Es decir que normalmente reaccionan de forma química y de distinta manera ante sustancias tales como la materia orgánica. Sin embargo, en ambos casos el efecto que se comprueba a simple vista es de corrosión.
Apariencia
Los ácidos tienen una consistencia aceitosa, algunas bases poseen un tacto jabonoso. En estado sólido normalmente son frágiles y porosos, teniendo presente la sustancia determinada. Algunos gases básicos o ácidos pueden ser vistos a simple vista.
Estados Físicos
Los álcalis y los ácidos se encuentran en cualquier estado de agregación de la materia: sea gaseoso, líquido o sólido, básicamente en polvo. Las formas gaseosas son las que tienen mayor riesgo humano e industrial debido a que usualmente no se pueden percibir antes de ser inhaladas y producen daños en el sistema respiratorio.
Aplicaciones de los Ácidos y las Bases
Los ácidos y las bases poseen muchas aplicaciones industriales, tales como:
- Bases: se usan mayormente como productos o desecantes que combaten la humedad ambiental. También como desinfectantes y sustancias de limpieza en las cuales se menciona el amoníaco, el cloro de las piscinas y el jabón. Las bases también se producen para combatir la acidez como fármacos, bicarbonato de sodio y leche de magnesia como purgante.
- Ácidos: sus propiedades de corrosión se utilizan para quitar la herrumbre y demás impurezas que poseen las sustancias industriales, tales como los metales. También se usan en reacciones químicas que posibilitan conseguir la electricidad, por ejemplo en las baterías. .os ácidos son parte de fertilizantes y usualmente se usan como catalizadores en reacciones químicas de control para conseguir productos determinados en el laboratorio.
Medición
Para establecer la medición del pH de las sustancias, se usa un tipo determinado de papel llamado papel tornasol. Hay diferentes presentaciones de este y en distintas tonalidades. La reacción que tiene frente a una base y un ácido es normalmente así:
- Base: el papel tornasol de color rojo se convierte en verdoso o en azul.
- Ácido: el papel tornasol azul se hace rosado, el de metilo de anaranjado se convierte en un tono muy intenso de rojo. Por otro lado, la fenolftaleína se queda incolora.
