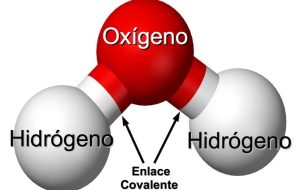
 El enlace covalente es definido como un enlace químico en el cual se unen dos átomos y comparten electrones en la más superficial capa atómica. Es decir, la que se ubica en el orbital atómico del final, la cual tiene mayor probabilidad de hallar un electrón rodeando al núcleo y entonces alcanzar un octeto estable, de acuerdo a lo dictado en la Regla del Octeto propuesta por Gilbert Newton Lewis. Los átomos que están enlazados transfieren uno o varios pares de electrones.
El enlace covalente es definido como un enlace químico en el cual se unen dos átomos y comparten electrones en la más superficial capa atómica. Es decir, la que se ubica en el orbital atómico del final, la cual tiene mayor probabilidad de hallar un electrón rodeando al núcleo y entonces alcanzar un octeto estable, de acuerdo a lo dictado en la Regla del Octeto propuesta por Gilbert Newton Lewis. Los átomos que están enlazados transfieren uno o varios pares de electrones.
Este enlace está diferenciado del enlace iónico porque los átomos que lo componen tienen una electronegatividad diferente y por debajo a 1,7. En el caso del enlace iónico, la diferencia sobrepasa el 1,7. Los enlaces covalentes son elaborados por átomos de diferentes o similares elementos no metálicos, entre el hidrógeno y un no metal.
Otra diferencia de los enlaces covalentes y los iónicos es que en la elaboración de los enlaces iónicos existe un intercambio de electrones desde un átomo hacia otro para crear iones de cargas que se oponen y que posteriormente son atraídas de manera electrostática. También el enlace iónico es creado por átomos de un no metal y de un metal.
Características del Enlace Covalente
Regla del Octeto
 Esta regla fue propuesta por Gilbert Lewis a inicios del siglo XX, para explicar la tendencia que los átomos tienen para unirse y conseguir que la capa electrónica externa esté cerrada o completa, tomando en cuenta su valencia.
Esta regla fue propuesta por Gilbert Lewis a inicios del siglo XX, para explicar la tendencia que los átomos tienen para unirse y conseguir que la capa electrónica externa esté cerrada o completa, tomando en cuenta su valencia.
La valencia es la cantidad de electrones que un átomo cede o acepta para completar la capa final. Los enlaces covalentes están regidos por este principio.
La capa completa estaría compuesta de 8 electrones. Por esta razón, un átomo que tenga una valencia 6 tomará un par más para completar mientras que un átomo que tiene valencia 2 buscará 6. En este estado los átomos tienen bastante estabilidad, similar a la presentada en los gases nobles.
Polaridad
- Se le llama polaridad a la propiedad que tienen los compuestos químicos para distribuir de manera desigual y no uniforme las cargas que se ubican en su estructura. Por esta razón guarda una relación bastante estrecha con la creación de dipolos eléctricos.
- De acuerdo a la presencia o a la ausencia de polaridad, se pueden diferenciar los enlaces covalentes polares que crean a las moléculas polares y los enlaces covalentes que no son polares, los cuales forman a las moléculas conocidas como apolares.
Enlaces covalentes apolares, también llamados no polares
- Están creados por átomos que pertenecen al mismo elemento químico, la electronegatividad también es similar. De igual manera, se crean por átomos de diferentes elementos químicos, pero estos poseen una electronegatividad diferente de muy pequeño tamaño, por debajo de 0,4.
- Debido a que la nube electrónica se atrae de igual manera por los dos núcleos, el dipolo no se forma en la molécula.
Enlaces covalentes polares
Se generan con átomos de distintos elementos químicos y que poseen una electronegatividad diferente, por encima de 0,5. El dipolo electromagnético es formado gracias a estos enlaces.
Dipolo eléctrico
Los enlaces covalentes de átomos pertenecientes a distintos elementos químicos normalmente producen una cambiante distribución sobre la densidad de carga eléctrica que se encuentra en el compuesto químico que se ha creado.
Esto permite la creación de un dipolo eléctrico, el cual se define como un sistema compuesto de dos cargas que tienen la misma magnitud y un signo opuesto.
Esta situación ocurre porque uno de los átomos tiene mayor electronegatividad que el otro, por lo tanto, tendrá mayor fuerza de atracción hacia sí mismo para acaparar a los electrones del enlace, produciendo de esta forma una densidad con características de carga negativa sobre el mismo y carga positiva en el otro átomo. Esto permite que el dipolo se forme.
Como consecuencia de todo este proceso, las moléculas covalentes se unifican con otras semejantes y elaboran estructuras moleculares de mayor complejidad. Cuando el enlace es formado usando átomos que forman parte del mismo elemento, la división y distribución de cargas hacia el compuesto químico que se ha formado será similar en toda la superficie de su estructura. Por lo tanto, el dipolo eléctrico no debe producirse.
Ruptura de enlaces covalentes
En el momento en el cual los átomos realizan sus enlaces de manera covalente, de estos se desprende energía. Por tal razón y con la finalidad de quebrar este enlace, se requiere un suministro para recuperar esa energía perdida el cual cambiará tomando en cuenta el tipo de átomos que se encuentran en el enlace y el tipo de enlace covalente que se forma.
Esto quiere decir que la energía de enlace es igual a toda la energía desprendida al momento de la creación de un mol caracterizado por enlaces covalentes. Esta misma energía es la que se debe emplear con el propósito de quebrar dicho mol de enlaces.
