 Las mezclas homogéneas se caracterizan entre varios aspectos porque tienen una única fase, parecen uniformes a simple vista, su composición es idéntica, casi todas son transparentes y no pueden filtrarse.
Las mezclas homogéneas se caracterizan entre varios aspectos porque tienen una única fase, parecen uniformes a simple vista, su composición es idéntica, casi todas son transparentes y no pueden filtrarse.
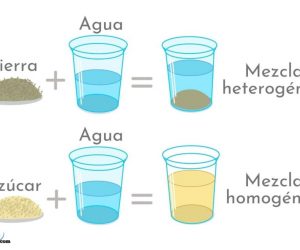
La mezcla se define como la unión de dos o varias sustancias químicas que mantienen sus identidades químicas. Las mezclas homogéneas son las distintas sustancias que la componen y que no se detectan con magnitudes ópticas ni a simple vista. Sus compuestos se encuentran en la misma fase y no tienen distintas propiedades en diferentes porciones.
Frecuentemente a esta mezcla se le conoce por el nombre de solución, una solución puede ser la mezcla de sal con agua. No importa la cantidad utilizada en ambos elementos, toda porción de la mezcla tendrá sal y agua en igual proporción.
Características de las Mezclas Homogéneas
Composición idéntica
 La distribución de las partículas encontradas en las mezclas homogéneas se caracteriza por ser uniformes. Esto significa que toda porción posee las mismas propiedades y la misma composición.
La distribución de las partículas encontradas en las mezclas homogéneas se caracteriza por ser uniformes. Esto significa que toda porción posee las mismas propiedades y la misma composición.
Un ejemplo de esta característica es el gas natural. Toda porción del gas tiene:
- Etano
- Metano
- Butano
- Propano
- Nitrógeno
- Dióxido de carbono
- Helio
- Hidrógeno.
Por esta razón, toda muestra tomada de este gas puede comprobar tener la misma exacta proporción de cada componente. Algo similar ocurre con el agua azucarada, cada vez que una muestra de la mezcla se pruebe, esta tendrá un nivel de dulzor igual.
Tienen una única fase
La materia existe en estado gaseoso, sólido o líquido, sin importar la clase de moléculas que las forman. Esta propiedad es llamada fase de la materia.
Una mezcla homogénea consiste en una única fase. De esta manera se realizan combinaciones de sólido y sólido, líquido y líquido, gas y gas. Sin embargo, también es posible realizar mezclas de sólido y líquido, gas y líquido en las cuales ambas resultan en líquido. Pero cada mezcla de gas y gas corresponden a ser homogéneas. Esto ocurre debido a que las moléculas de gas se encuentran muy alejadas entre ellas, permitiendo espacios vacíos grandes.
Por otra parte, para conseguir una mezcla homogénea correspondiente a dos sólidos, ambos deben atravesar un proceso de fusión. Cuando los componentes se funden, se mezclan y luego se solidifican. Esto ocurre con las aleaciones.
Algunos ejemplos son:
- Sólidos: estaño y cobre da bronce.
- Líquidos: alcohol y agua.
- Líquido y gas: vapor de agua.
- Gases: nitrógeno y oxígeno da aire.
- Líquido y sólido: azúcar y café líquido.
No pueden filtrarse
Aunque las mezclas pueden ser separadas al usar diferentes procesos mecánicos o físicos, el filtrado no conseguirá la purificación cuando son mezclas homogéneas. De esta forma, si el vinagre pasa por un filtro, los dos componentes del mismo los cuales son ácido acético y agua no serían separados.
Aparentan ser uniforme a simple vista
Los elementos de las mezclas homogéneas a simple vista no pueden distinguirse ni tampoco se observan discontinuidades. Un ejemplo es que al observar un café con azúcar y leche no se puede distinguir la parte de la leche, del azúcar o del café.
Por el contrario, esto no ocurre con las mezclas heterogéneas como sucede al combinar pimienta y sal o arena y azúcar, caso en el cual es posible notar de forma clara los elementos. En ocasiones no se puede reconocer solo con la observación si es una solución o un solvente. Un vaso de agua pura aparenta ser similar a un vaso de agua con sal.
Casi todas son transparentes
Exceptuando las mezclas homogéneas sólidas, las demás son transparentes en su totalidad. Es decir, se puede observar a través de estas. Aun teniendo una tonalidad, esta propiedad es conservada.
Métodos de Separación en Mezclas Homogéneas
Cromatografía
Se usan las interacciones entre solutos separados en fase estacionaria y en fase móvil. Un ejemplo son las extracciones de clorofila que se hacen por primera vez para identificar los distintos tipos de clorofila.
Extracción
Está basada en la polaridad, como usar alcoholes y cloroformos para la extracción de líquidos.
Evaporación
Se obtiene la sal marina de manera artesanal. Este proceso se usa para dividir la sal del agua a través de la evaporación.
Cristalización
Está basada en controlar la presión, la temperatura y la solubilidad en solventes calientes o fríos tales como los procesos para obtener el azúcar blanco o azúcar moreno.
Destilación
Se separan dos o varios líquidos que poseen distintos puntos de ebullición. Un ejemplo es la destilación de uvas, mezcal y caña de azúcar para la extracción del alcohol a través de la planta.
