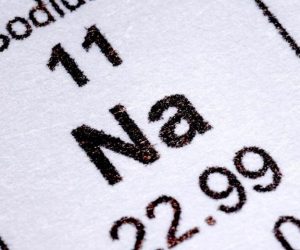 Se le llama sodio al metal alcalino perteneciente al grupo 1 en la tabla periódica, está representado por Na como símbolo químico y su número atómico corresponde a 11. Este metal es liviano, tiene menor densidad que el agua. Su tonalidad es plateada y blanca, convirtiéndose en gris cuando entra en contacto con el aire; por esta razón es almacenado en gases nobles o parafinas.
Se le llama sodio al metal alcalino perteneciente al grupo 1 en la tabla periódica, está representado por Na como símbolo químico y su número atómico corresponde a 11. Este metal es liviano, tiene menor densidad que el agua. Su tonalidad es plateada y blanca, convirtiéndose en gris cuando entra en contacto con el aire; por esta razón es almacenado en gases nobles o parafinas.
El sodio también es un metal blando, puede cortarse usando un cuchillo y se hace quebradizo en temperaturas bajas. Tiene una reacción explosiva al estar en agua formando hidrógeno gaseoso e hidróxido de sodio. También reacciona con la humedad de las manos y con el aire húmedo.
El metal es hallado en rocas minerales de sal, tales como el cloruro de sodio, en el mar y en salmueras. El sodio es el sexto elemento más abundante en el planeta. El análisis hecho a los espectros de luz que se originan de las estrellas ha dado como resultado la detección del sodio, en estas incluido el Sol. También se ha encontrado en meteoritos.
Características del Sodio
Nomenclatura
El sodio tiene un número único de oxidación de +1, por lo que los nombres de cada uno de sus compuestos los cuales se rigen de acuerdo a la nomenclatura stock son simplificados porque este número no se especifica con números romanos y entre paréntesis.
De igual manera, los nombres tomando en cuenta la nomenclatura tradicional finalizan con el sufijo -ico. Un ejemplo de esto es el cloruro de sodio o NaCl, de acuerdo a la nomenclatura stock. También se llama monocloruro de sodio de acuerdo a la nomenclatura sistemática y según la nomenclatura tradicional, se le llamaría cloruro sódico. Pero sal de mesa es su nombre más común.
Números de oxidación
Al tener un orbital de valencia 3s, el sodio pierde el único electrón que tiene generando una rápida transformación al catión Na+, este es un isoelectrónico del neón. Esto significa que el Ne y el Na+ poseen la misma cantidad de electrones. Si la presencia de Na+ es asumida en el compuesto, entonces se entiende que su número de oxidación corresponde a +1.
Si ocurre lo contrario, en el caso de que el sodio gane un electrón, la configuración electrónica que se obtiene es [Ne]3s2, siendo un isoelectrónico del magnesio y un soduro del anión Na-. Si la presencia del Na- se asume en el compuesto, esto significa que el sodio obtendrá un número de oxidación igual a -1.
Riesgos del Sodio
Este metal tiene una intensa reacción con el agua. Es por esto que cuando hace contacto con los tejidos humanos que están rodeados de agua, puede producir severos daños. Genera graves quemaduras por contacto con los ojos y con la piel.
De igual forma, al ingerir el sodio es posible que se produzca una perforación del estómago y del esófago. Pero a pesar de que estas son graves lesiones, sólo una proporción pequeña de la población se encuentra expuesta a las mismas. El daño mayor que el sodio puede ocasionar se debe a su excesiva ingesta en las bebidas y en las comidas realizadas por la gente.
El cuerpo humano necesita de una diaria ingesta de sodio de 500 mg para que la función en la conducción nerviosa se cumpla, también en la contracción muscular. Pero normalmente el sodio se ingiere en una cantidad mucho mayor en la dieta, produciendo un aumento en la concentración sanguínea y plasmática de este. Pudiendo ocasionar enfermedades cardiovasculares, hipertensión arterial y accidentes cerebrales.
La hipernatremia es una enfermedad que se asocia a la producción de la osteoporosis porque induce a que el calcio salga del tejido óseo. Los riñones presentan problemas para el mantenimiento de una concentración plasmática normal de sodio, aún por su excesiva ingesta, llevando a estos a sufrir un daño renal.
Usos del Sodio
- El sodio metálico se emplea en la metalurgia como reductor y agente desoxidante para preparar circonio, calcio, titanio, etcétera. El sodio fundido es útil como agente de transferencia de calor para refrigerar algunos reactores nucleares.
- También es usado como materia prima para la manufactura del sulfato de lauril sódico, de igual forma en la manufactura de polímeros y para producir síntesis de perfumes y tintes. El sodio permite la purificación de hidrocarburos y se usa en la polimerización de hidrocarburos insolubles, en muchas reducciones orgánicas también.
- Al disolverse en amonio líquido, sirve para bajar los niveles de alquinos a transalqueno. Con el sodio se elaboran lámparas de vapores para alumbrar a las ciudades y funciona como un desecante que presenta una tonalidad azul cuando hace contacto con la benzofenona.

